


一、胶体理论
导致胶体粒子团聚的主要作用,是来自粒子间的范德华力,若要增加胶体粒子稳定性,则由两个途径,一是增加胶体粒子间的静电排斥力,二为使粉体间产生空间位阻,以这两种方式阻绝粉体的团聚。
最简单的胶体系统系由一分散相与一相分散媒介所构成,其中分散相尺度范围于10-9~10-6m间。胶体内的物质存在于系统内需具有一定程度以上的分散能力。根据溶剂与分散相的不同而可产生多种不同的胶体型态,如:雾气即为液滴分散于气体中之气胶、牙膏即固态高分子微粒分散在液体中的溶胶。
胶体的应用在生活中比比皆是,而胶体的物理特性需视分散相与分散介质的不同而有所差异。从微观角度观察胶体,胶体粒子并非处于恒定状态,而是在介质内随机运动,这便是我们所称的布朗运动(Brownian motion)。绝对零度以上,胶体粒子均会因热运动而发生布朗运动,这便是微观胶体的动力学特性。胶体粒子因布朗运动而产生碰撞,是为团聚(aggregate)发生的契机,而胶体粒子在热力学上处于不稳定状态,因而粒子间的交互作用力为分散的关键因素之一。
1-1,胶体动力学性质
布朗运动起始自19 世纪初,植物学家布朗由显微镜观察到花粉粒子在水中的不规则运动得名。粒子因温度而造成布朗运动后将产生碰撞行为,由粒子表面的范德华力引起团聚现象。胶体的凝聚速率与以下两者有密切的关系:
1)胶体粒子间彼此碰撞的频率,
2)粒子经碰撞后,产生的热能是否足以克服胶体间的排斥能量。
Smoluchowski 提出胶体快速凝聚理论,是由浓度差造成扩散速率所控制。
胶体粒子团聚的速率为:

n表示在时间t时,单位体积溶液所含的胶体粒子数,k2为二次反应速率常数(second-order rate constant)。
由于团聚使得溶液中的胶体粒子浓度减少,因此以表示为负号。当t=0,n=n0, 积分上式可得:
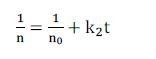
胶体部分团聚后,由于排斥能障将随粒子的粒径增加而成长,溶液将达到平衡,使得凝聚速率下降。假设胶体粒子为单一粒径,并只考虑两粒子间的碰撞时:
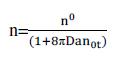
a为胶体粒子半径,D为布朗扩散系数,假设为球形粒子,由爱因斯坦扩散定律,可得:
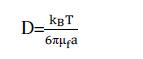
将(4)代入(3)后,n 代入(2)式化简得到:
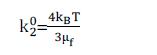
K02为扩散速率拉制时的胶体凝聚速率(不考虑能障时的速率常数),μf 为水溶液黏度。并由(1)及(5)式可计算出团聚时间tF为:
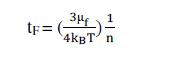
1-2, 双电层理论
双电层理论可用以解释胶体中带电离子的分布情形,以及粒子表面所产生的电位问题。19 世纪Helmholtz 提出平行电容器模型以描述双电层结构,简单的假设粒子带负电,且表面如同电容器中的电极,溶液中带正电的反离子因异电荷相吸而吸附在粒子表面。然而这个理论却忽略了带电离子会因热运动产生扩散行为。
因此,在20世纪初Gouy与Chapman 提出扩散双电层模型,在溶液中的反离子会因静电作用吸附于带电粒子表面,同时受热运动影响而在粒子周围扩散。因此,反离子在溶液中的分布浓度将随粒子表面的距离增加而下降。1924 年,史特恩(Stern)将平行电容器与扩散双电层两种模型加以结合,以描述双电层结构。Stern认为反离子会在粒子表面形成紧密的吸附层,亦称Stern layer,随着与粒子表面距离增加,粒子的电位会呈现线性下降,同时Stern layer外亦有扩散层的存在,并且粒子于扩散层中的电位会随距离增加而指数下降。
下图为Stern双电层模型,zeta电位(ξ,Zeta potential)为双电层模型中极重要的参数,实际测量时并无法直接测得粒子的表面电位,但可由声波法或是电泳法计算出粒子的zeta电位。双电层模型中Stern 层与扩散层间的剪切平面上存在zeta电位。
zeta电位与胶体的分散稳定性有密切的关系,当zeta电位愈大时,胶体粒子表面上的静电荷愈多,当粒子于水溶液中的zeta电位达到±25~30mV 以上时,胶体有足够的静电排斥力克服粒子间的范德华力以维持胶体稳定性。
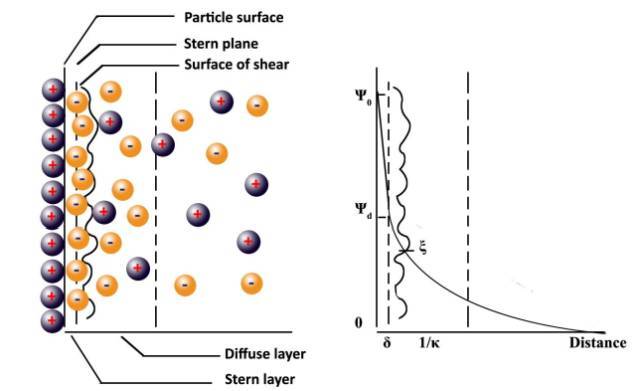
Stern 双电层模型
而胶体粒子表面的电荷有:
1)离子解离(Dissolution)
离子结晶型胶体粒子,组成离子具有不同的分解速率,产生表面电荷。离子与粒子表面和液相间的亲和性不同,也是粒子表面带电的原因之一。
2)离子化(Ionization)
当胶体表面具有额外的强酸碱、弱酸碱等官能基,如:羧酸或胺基等时,这此表面活性基会与溶液中的氢离子或氢氧根离子反应,产生如COO-、NH3+ 等使粒子表面带负电或正电。
3)离子吸附(Ion adsorption)
胶体表面的净电荷可由溶液中不同的离子吸附情形产生,导致粒子表面带过多的正电荷或负电荷。
4)电子亲和性(Electron affinities)
两相之间的电子亲和力不同时,会产生接触电位(contact potential),使电荷分离。
5)缺陷(Imperfection)
当粒子内部具有杂质时,例如:部份离子被同离子取代,不同价数的离子取代行为或者具有空位等缺陷均会使粒子表面带有电荷。
6)偶极分子的吸附与取向性
胶体粒子表面吸附有偶极分子时,虽不影响胶体净电荷,然而将改变双电层中的电荷分布,使得电荷分布不均。粒子表面带电量将直接影响到胶体的稳定性。胶体表面的电荷会将反离子(Counter-ion)吸引至粒子表面,并且排斥共同离子(Co-ion)。经由静电作用与热运动,反离子吸附于粒子表面,而过剩的共同离子则扩散于溶液里,造成了双电层的电荷分布。
二、DLVO理论
1940-1948年,由Deryagin、Landau、Verwey、Overbeek 建立胶体粒子相互接近时的能量变化及对胶体稳定性影响的相关理论,简称DLVO理论。其理论主要描述胶体粒子间距与能量变化的关系,此作用能量是胶体双电层重迭的电荷排斥能与范德华力加成下的结果。
下图为DLVO示意图,表示胶体粒子之间存在吸引力与排斥力,这两种作用力的大小决定胶体溶液的稳定性,粒子间的吸引力为主要作用,则粒子将产生团聚;而排斥力大于吸引力的状态下,则可避免粒子凝聚而保持胶体的稳定性。
由DLVO曲线,当粒子之间的距离愈来愈短,粒子首先会产生吸引力,若粒子彼此再持续靠近时,则将使得粒子之间产生排斥力,而若粒子越过排斥能障,则会快速产生团聚。因此为了使得胶体内的粒子分散稳定性提高,必须提高粒子间排斥力,以避免粒子间产生团聚。
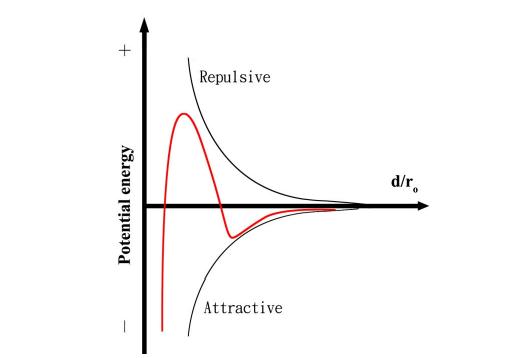
DLVO示意图
2-1,胶体的稳定机制
胶体粒子由于具有高表面能而倾向团聚状态,为使胶体系统具有分散稳定性,必须提高粒子间的排斥力。胶体间的稳定机制一般可分为三种:
1)静电稳定机制(Electrostatic stabilization)
2)立体障碍(Steric hindrance)
3)静电立体稳定作用(Electrosteric stabilization),稳定机制如下图所示:
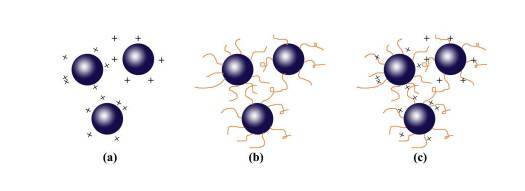
(a)静电斥力、(b)立体障碍、(c)静电立体障碍
静电稳定机制是利用粒子的表面电荷所造成的排斥力,当粒子彼此因吸引力接近时,造成胶体粒子的双电层重迭,由于粒子表面带同性电荷,因此产生排斥力。
然而静电稳定机制易受溶液系统中的电解质浓度影响,当溶液内的电解质浓度过高时将造成粒子表面双电层压缩,反而造成粒子的凝聚。立体障碍的稳定机制是利用高分子吸附于胶体粒子表面,其作用会产生两种不同的效应提升粒子间的排斥力:
1)渗透压效应(Osmotic Effect)
是当两胶体粒子接近时,高分子长链吸附于粒子表面或溶液内的残余高分子会介在粒子之间,此时粒子间的高分子浓度不断提高将引起渗透压的变化,周围介质进入两粒子之间,排开彼此距离,而达到分散稳定的效果。
2)空间限制效应(Volume restriction effect)
为吸附于粒上表面的高分子具有一定的空间阻碍,当粒子距离缩短,由于高分子并无法穿透粒子,高分子将产生压缩,致使弹性自由能上升,因而排开粒子,达到分散的效果。
相较于静电稳定机制,高分子立体障碍具有许多优点。静电稳定机制极容易受环境影响而失去效果,无法应用于高电解质环境或是有机系统溶液。
然而高分子立体障碍对电解质浓度相对不敏感,而且于水溶液或在有机溶剂中具有相等的效率,并且高分子立体障碍亦不因胶体固含量而影响效果。高分子吸附于胶体粒子表面时,即使产生团聚亦为软团聚,可简单的破除团聚现象,即使胶体粒子经过干燥程序,仍然是可以再度分散于溶剂中。
因此立体障碍对于分散稳定性的作用相对较静电稳定效应高。静电立体稳定作用则是同时具有静电稳定机制与立体障碍,粒子表面所接枝的高分子上带有电荷,使两种不同稳定机制加成,可让胶体粒子具有良好的分散稳定性。
 /4
/4 
文章评论(0条评论)
登录后参与讨论