


作为一种将微流控芯片技术与液滴技术相结合的新兴技术, 液滴微流控技术具有更高的实验效率和更精确的操作控制能力. 液滴微流控技术可以实现液滴精确控制, 实现液滴之间的快速混合和反应, 液滴作为反应容器, 可以容纳多种物质以及微小颗粒, 在高速流动的微通道中可以实现高通量的分析和检测. 液滴微流控技术可以应用于生物医学研究中更复杂的微观实验操作和分析, 尤其是在高通量单细胞分析实验和材料合成等相关应用中承担重要角色. 单细胞的排列、分离和隔离, 药物与细胞的共封装, 是液滴微流控技术应用的关键步骤.
众所周知, 微流控液滴封装技术存在一个基本限制: 泊松限制. 悬浮在离散相中的微粒或细胞封装过程中是随机的接近封装区, 导致每个液滴中的粒子或细胞数量的不确定性, 液滴封装粒子数量往往成正态分布, 单粒子的封装率一般为20% ~ 35%. 泊松分布的存在限制了微流控封装技术的进一步发展. 近年来, 研究者尝试开发各种各样主动或被动的方法去摆脱泊松限制, 从而提高液滴封装效率. 例如使用惯性排序以及使用激光干扰细胞封装等. Kemna等通过设计螺旋通道引入迪恩力, 实现了粒子的有序排列, 从而提高封装率. 然而, 随着流量条件的改变, 会有多个平衡位置出现, 不利于单粒子封装. Harrington等设计了双螺旋结构, 将迪恩夹带应用于细胞与微粒, 通过定义不同的体积比来实现有效共封装, 并调节体积比缩放以确定最佳封装条件. 螺旋结构存在的主要问题是迪恩力会将粒子的平衡位置推向边缘, 沿着通道边缘运动的粒子在封装区会受到液滴头内部流场的影响卷入通道中心, 从而影响封装效果. Edd等在高纵横比通道下严格控制粒子有序化的附加程度, 使其产生精确交错的纵向间隔的两个液滴列, 并结合复杂的光学设备实现了细胞及微粒受控的高效封装. 然而, 这种方法缺乏稳健性且容易破坏细胞活性, 难以满足细胞封装的生物相容性要求.
需要指出的是, 现有实验研究大多使用牛顿流体, 而在实际生物医学应用中的流体介质往往具有明显的非牛顿性质, 如剪切稀化和黏弹性等. 与牛顿流体相比, 非牛顿性质的引入会影响液滴生成的模态. 由于流量条件以及流体性质的不同, 常见的液滴微流控生成通道中存在5种基本的液滴生成模式: 挤压、滴流、射、尖端流及尖端多液滴破碎模态. 了解非牛顿液滴生成模态是稳定制备高单分散性非牛顿液滴的前提条件, 而单分散性是保证液滴封装环境均一的关键环节. 在保证单分散液滴生成的基础上, 若可实现粒子或细胞在离散相中有序排列, 有望大幅提高封装效率.
在微流控平台实现微粒的高效封装之后, 封装率的检测也是应用中的重要环节. 传统的液滴封装率以手动计算为主. 基于液滴微流控技术的粒子封装具有高通量特点, 这使得数据量较为庞大, 且液滴密集以及图片大小和清晰度等问题无疑会为手工计算增加难度. 通过图像处理实现粒子封装率的自动计算应是解决之道. 现有算法包括卷积神经网络、YOLO和DETR等. 其中, 卷积神经网络适用于处理图像特别是图像识别; YOLO算法检测速度非常快, 但对相互靠近的物体, 以及很小的群体检测效果不好; DETR算法简化了目标检测的网络架构, 但需要更长的训练时间来收敛. 新近发展的Deformable DETR算法结合了DETR算法的图上检测能力, 也解决了收敛速度慢和特征空间分辨率有限的问题, 有望应用于复杂场景下粒子的封装率检测.
基于上述分析, 本文旨在发展基于非牛顿微液滴的粒子封装及检测技术. 首先, 基于流动聚焦微通道和聚合物溶液开展非牛顿液滴生成实验, 研究不同非牛顿液滴生成模态. 其次, 选取兼具剪切稀化与弹性效应的非牛顿流体, 结合粒子惯性-黏弹性排序, 探索不同流量条件和不同液滴生成模态下粒子封装效率. 最后, 建立Deformable DETR粒子封装检测模型, 实现了粒子封装的高精度检测. 研究结果可在一定程度上拓展对于液滴微流控基础理论的认识, 为优化基于非牛顿微液滴的粒子封装技术提供一定参考.
材料和方法
1. 流体配置
实验选取橄榄油作为连续相流体, 其密度和黏度分别为0.92 g/cm3和78 mPa·s; 选取3种聚合物溶液作为离散相流体, 分别为聚环氧乙烷水溶液(PEO)、聚乙烯吡咯烷酮水溶液( PVP)、黄原胶水溶液(XG). 离散相的牛顿流体对比项选用甘油-水混合液( GW, 60 wt.%). 所使用聚合物均配置时未做其他处理. 聚合物溶液采用回旋振荡器以100 r/min的速率混合1 ~ 2 d; 甘油-水混合液直接按照配比质量分数加入去离子水, 充分摇混即可. 所有配置溶液静置6 h以上再进行后续实验.
含粒子的溶液配置时, 将50 mg/mL直径为20 μm的聚苯乙烯微球(CV 3.1%, 中科雷鸣) 添加到离散相溶液中, 装入密封容器中进行混匀, 使用工作频率为40 kHz, 功率为100 W的超声清洗机对装载粒子的离散相溶液进行隔水超声处理, 避免粒子聚团, 配置成粒子浓度为0.5 wt.%的离散相溶液.
2. 芯片设计与加工
图1展示了本研究所设计的芯片结构示意图, 微通道的宽度(W)和深度(H)均为 100 µm. 矩形结构尽可能减少壁面对液滴生成的影响, 并且可以基于二维图像合理地分析液滴生成过程. 在粒子封装过程中, 为尽可能避免粒子分布受入口切面的影响, 将入口与出口孔径设计为800 µm. 粒子在通道中杂乱排列, 使得被封装的粒子具有随机性, 使粒子封装存在基本的泊松限制, 在离散相前端通道设计蛇形通道, 蛇形通道的单程长度L1 = 4 mm, 主通道长度L = 2 cm为粒子平衡提供空间距离. 为简化连续相输入控制, 将两侧连续相通道在外侧合并成一个主入口. 主入口的连续相和离散相的流量分别用 Qc 和 Qd表示. 可知, 连续相两侧通道流量各为Qc/2.
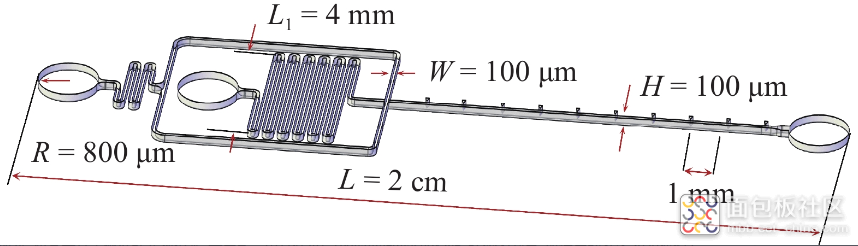
图1 芯片结构示意图及几何参数
微流控芯片实物如图2所示. 芯片是基于标准软光刻技术, 采用聚二甲基硅氧烷(PDMS)制备. 将PDMS与固化剂按10: 1的比例配置并使用玻璃棒搅拌, 直至混合液中充满小气泡, 放入真空容器中脱气之后在掩模板上浇铸, 在真空容器中进行二次脱气后放入70 °C干燥箱中烘烤2 h. 烘烤结束之后, 将固化好的PDMS模块剥离掩模板, 使用切割器PDMS分割出所需模块, 用外径1 mm的打孔器在入口和出口处打孔, 然后将PDMS模块氧等离子体键合到玻璃显微镜载玻片(25 mm × 75 mm)上, 使用聚乙烯管连接芯片入口与注射器上的25 G针头, 连接周围使用专用胶进行加固.

图2 芯片实物图
3. 实验操作及数据处理
微流控芯片固定在倒置显微镜载物台上, 使用高精度流量泵驱动两个1 mL注射器分别将离散相和连续相流体以恒定流量通入微通道中. 两相流体在流动聚焦结构处相遇, 在合适流量条件下, 连续相橄榄油剪切离散相聚合物溶液形成微液滴. 实验中的流量通过流量泵调节, 流量参数直接读取即可. 本实验的流量为Qd = 10 ~ 100 μL/h, Qc = 100 ~ 3000 μL/h. 液滴生成及粒子封装过程通过高速相机以2000帧/秒的速度记录. 所有实验均在室温下进行. 图3展示了液滴检测及封装率计算模型. 本文验证了其在单液滴与多液滴场景下粒子封装率高精度检测的有效性, 具体过程在后续结果与讨论部分详述.
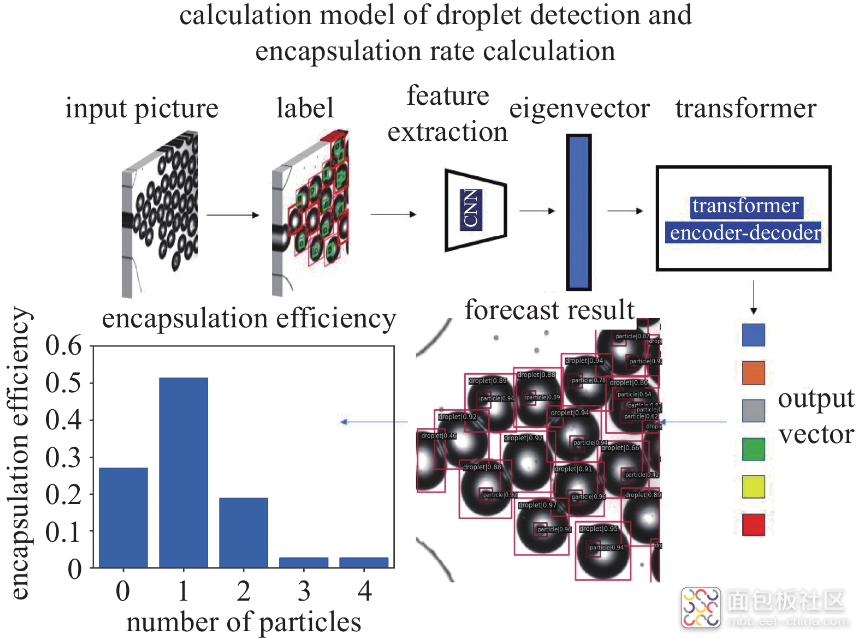
图3液滴检测及封装率计算模型及工作流程
免责声明:文章来源汶颢www.whchip.com 以传播知识、有益学习和研究为宗旨。 转载仅供参考学习及传递有用信息,版权归原作者所有,如侵犯权益,请联系删除。
 /5
/5 
文章评论(0条评论)
登录后参与讨论