[初次发表 24-04-23 最后编辑:24-04-25]
前一篇说的是独立原子的结构,这一篇记录分子。
分子由2个及以上的原子组成,既可以是相同原子(元素单质),也可以是不同元素的原子(化合物)。组成分子的原子保持原子核完整,质子数不变,电子轨道/云相互融合,也可以视为原子团。如果原子的质子数变化,那么就不再是分子,而是生成新物质原子。
根据原子核对共享电子对吸引力的大小不同,定义了电负性(Electronegativity)。氧气、氮气这样的双原子分子,键两侧原子核的电负性相同,共享电子不偏不倚地位于两个原子核中间。两个原子核相互作用,原子核之间相互排斥,同时原子核又吸引电子对,达成平衡。如果原子核的电负性差距很大,例如金属盐分子,那么共享电子对将显著地趋向于电负性较强的原子附近,出现极化(polar),形成偶极子(dipole)。
单个原子核(正电荷)在空间中形成的静电场,外形像一个喇叭状的井。带负电荷的粒子被束缚在这个井内。能量较低的电子,位于井的深处,靠近原子核;相反,外层电子靠近井口,具有更高的能量。这个情况类似于引力场、磁场。
当多个原子聚集时,静电场的形状会改变。除了最外侧,所有被其它原子簇拥着的原子,静电场的“井壁”高度都会下降,使轨道发生“杂化”。原本等级分明的能级,因为杂化而变成密集的能带。原本被束缚在井内的最外层电子,因为井壁下降,变得可以在多个原子之间自由移动,成了自由电子。金属晶体存在大量Unlocational Electron(非定位电子),可以解释金属优异的导电性。
对于硅这样的IV族元素,单个原子最外层电子数是4。多个原子聚集后,第3能级的3s和3p轨道发生杂化,形成4个sp轨道,且最多可以容纳 4 对电子。这样,每个硅原子可以和相邻的 4个硅原子共享电子,硅原子之间相互通过4个电子耦合,形成稳定的“面心立方”或者“金刚石结构”。平面化表示,就是4个十字正交的共价键。
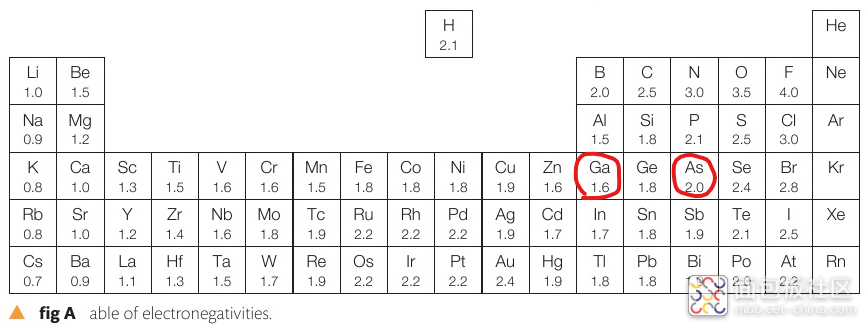
GaAs/砷化镓是III族-V族化合物,Ga 和 As 有不同的电负性,不过差异不大(0.4)。Ga的3个外层电子会与As的5个外层电子形成 3 个共享电子对和1个孤立电子对(Lone paired electrons)。GaAs晶体内同样没有自由电子,不导电。
SiC/碳化硅是IV族化合物,Si 和 C 的电负性差异是0.7。分子内有4对共享电子对,没有自由电子,不导电。
GaN/氮化镓是III族-V族化合物,Ga 和 N 有不同的电负性,差异中等(1.4)。Ga的3个外层电子会与N的5个外层电子形成 3 个共享电子对,和1个孤立电子对。GaN晶体内没有自由电子,不导电,但是它的极化程度较大,具有和其它化合物不一样的特性。
按元素周期表的次序,不同元素电负性的数值如下:
(图来自Ref 1)
化学键是一种原子之间或者原子团之间的相互作用,这种相互作用能导致原子聚集,并且这种聚集的稳定性足够好,可以被实验观测到。
传统化学理论认为,化学键是原子核-电子之间的吸引力与原子核之间的排斥力、电子之间的推斥三者相平衡的状态。键两侧的原子可看作是在用“拔河”的方式分享彼此的部分电子,这部分电子在静电力平衡时处于两个原子核之间一个相对稳定的位置。而共振理论认为,分子尤其是有极性的分子,电子的运动造成了多个极化结构的共振,使原子核之间的排斥作用与极化分布的电子对所有原子核的吸引作用相平衡。
Si 晶体中原子之间的相互作用是对等的,是一种纯共价键(Pure Covalent Bond)。
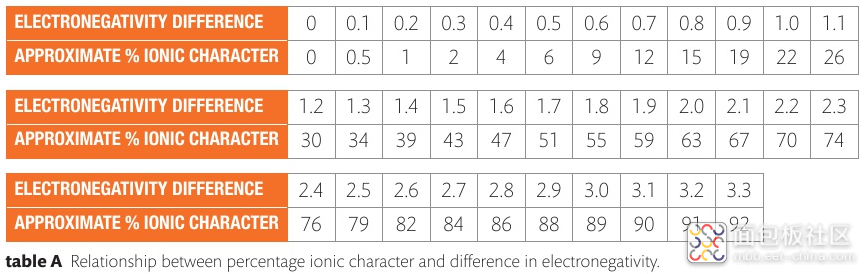
GaAs 晶体的电负性差异是 0.4,是一种弱极性(4%)的共价键(Polared Covalant Bond).
SiC 晶体的电负性差异是 0.7,是一种弱极性(12%)的共价键.
GaN 晶体的电负性差异是 1.4,是一种极性较明显(39%)的共价键.
(图来自Ref 1)
Ref:
1. Cliff Curtis.IAS Chemistry Student Book 1, Pearson, 2017
2. 鲍林[美].化学键的本质.北京大学出版社.2021





 /2
/2 
文章评论(0条评论)
登录后参与讨论