


近日,中国科学院国家纳米科学中心研究员孙佳姝团队和中国人民解放军总医院第五医学中心教授张少华等合作,开发了新型微流控脉冲过滤技术与高灵敏热泳检测平台,实现了全血样本中肿瘤细胞外囊泡(Extracellular vesicle,EV)的高效分离分析并用于乳腺癌早期诊断。相关研究成果以Cascaded microfluidic circuits for pulsatile filtration of extracellular vesicles from whole blood for early cancer diagnosis为题,发表在《科学进展》(Science Advances)上。
细胞外囊泡(EV)是脂质双层封闭的生物颗粒,直径为30至250nm,由大多数哺乳动物细胞(尤其是肿瘤细胞)主动分泌到周围环境中,并在细胞间通讯中发挥重要作用(1-53)。肿瘤衍生的EV(tEV)携带反映细胞起源分子特征的蛋白质和核酸的有效载荷,并且在血液等体液中大量发现。因此,电动汽车被认为是液体活检生物标志物的有前途的来源,用于早期癌症诊断和肿瘤发展的实时监测(4-9)。然而,电动汽车分析的一个主要障碍是缺乏标准化、自动化和可重复的方法来分离和纯化电动汽车。为了从全血样品中分离EV,包括超速离心(UC)在内的顺序离心现在是金标准,涉及多个离心步骤以去除血细胞,细胞碎片和其他干扰物质(6,10,11)。整个工作流程既费时又费力,需要使用多种专用仪器。此外,较长的UC周期可能导致具有蛋白质聚集体共沉淀的EV产量低(12,13)。其他几种分离方法,如基于聚乙二醇(PEG)的沉淀、体积排阻色谱、免疫亲和捕获和微流体分离,已被应用于分离EV,在形态、纯度和产量方面具有不同的结果(14-21)。因此,迫切需要开发高性能、快速、集成且具有成本效益的电动汽车与生物体液隔离技术。
膜过滤是通过使用微/纳米多孔膜作为尺寸排阻过滤器(尺寸排除过滤器)对EV进行尺寸选择性分离的替代策略(22,23)。据报道,集成了多个具有不同膜孔径的过滤器模块的外泌体全分离芯片可从血浆和尿液中分离出尺寸范围为30至200nm的EV(24)。包含两个纳米过滤器的离心微流体装置允许在30分钟内从尿液中自动富集尺寸小于600nm的EV(25)。对于这些死角过滤设备,膜污染是一个主要问题,会导致性能下降,电动汽车回收率降低。此外,死端过滤中的高压和剪切力可能会对EV(造成损坏26,27)。为了减少过滤器堵塞,设计了一种双膜过滤方法,结合谐波振荡,通过在膜表面周围定期重悬EV从尿液样本中提取EV(14)。然而,高频振荡(3至7kHz)的应用几十分钟可能会改变EV(的大小和完整性28,29)。此外,对复杂的外部控制系统的需求可能会限制膜过滤在临床应用中的广泛使用。
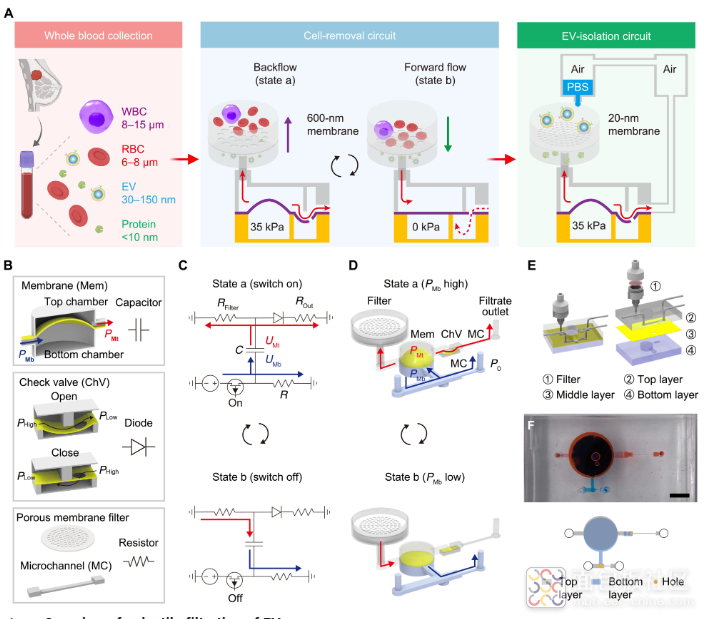
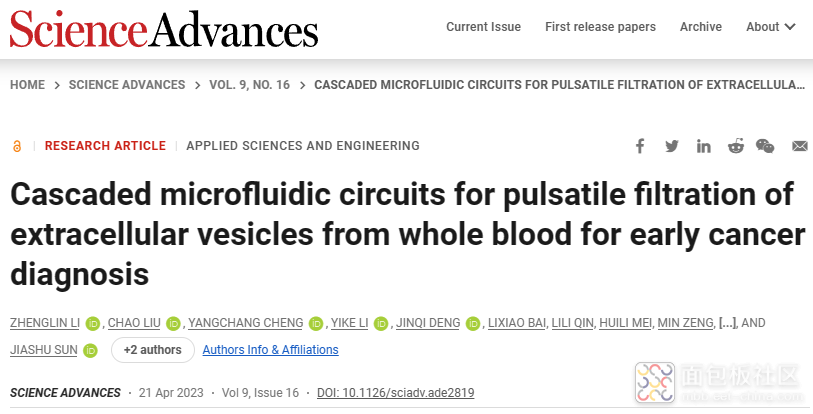
在这里,我们设计了级联微流体回路,用于直接从全血样本中对EV进行脉冲过滤(图1A)。该平台由一个安装有外部聚碳酸酯(PC)膜过滤器(孔径为600nm)的细胞去除电路和一个带有阳极氧化铝(AAO)膜过滤器(孔径为20nm)的EV隔离电路组成。在电路类比的基础上,设计的微流体回路可以产生通过多孔膜的脉动流,将颗粒从表面抬离,从而抑制过滤器结垢和颗粒聚集(图1A)。微流体脉动过滤可在 30 分钟内快速、高产、高纯度地分离非转移性乳腺癌 (NMBC) 血液样本中的 EV。通过一步法PEG增强型热泳适体传感器(pTAS)在不到15分钟的时间内测量分离EV的蛋白质谱,以诊断NMBC。
肿瘤EV是肿瘤细胞主动分泌到外周血等体液环境中的纳米尺度(30-250 nm)磷脂囊泡,在肿瘤发生发展过程中发挥重要作用。发展简单、快速、高效且标准化的EV分离分析方法,已成为肿瘤液体活检领域的关键技术问题。
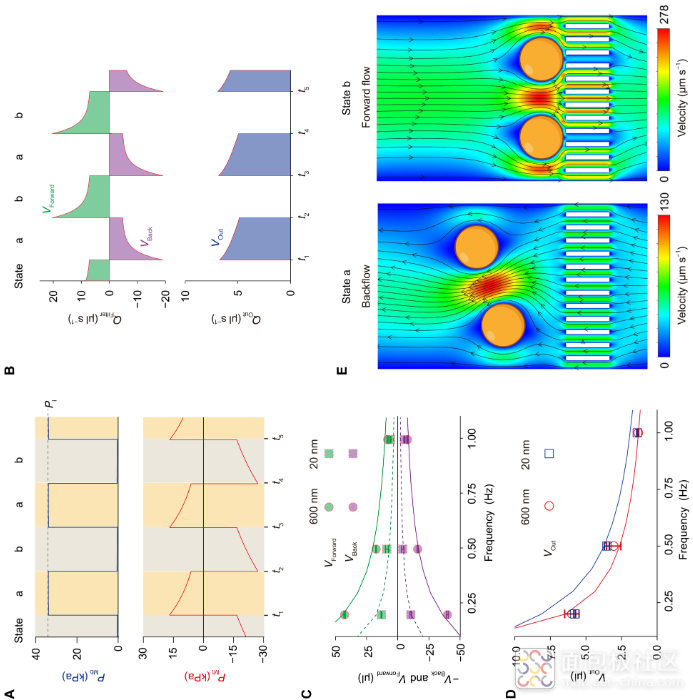
本工作利用流路-电路类比设计策略,制备了集成微通道(电阻)、弹性薄膜(电容)、单向阀(二极管)等元件的微流控脉冲过滤系统。该系统仅需使用单向脉冲气压驱动,便可产生可往复穿过多孔滤膜的微升级脉冲流,从而抑制滤膜堵塞和颗粒堆积,有效提升过滤效果。通过级联600纳米孔径滤膜(用于血细胞去除)和20纳米孔径滤膜(用于游离蛋白、游离核酸、脂蛋白等干扰物去除),该方法可在30分钟内从全血样本中高效完整地分离纯化EV,回收率高达80%。科研人员进一步利用PEG增强热泳的核酸适体传感平台,在15分钟内一步法高灵敏检测EV携带的肿瘤相关蛋白,实现了早期乳腺癌患者精准诊断,准确率达91%。
研究工作得到中科院战略性先导科技专项、中科院稳定支持基础研究领域青年团队计划、国家自然科学基金和国家重点研发计划等的支持。
免责声明:文章来源汶颢 www.whchip.com 以传播知识、有益学习和研究为宗旨。 转载仅供参考学习及传递有用信息,版权归原作者所有,如侵犯权益,请联系删除。
 /3
/3 
文章评论(0条评论)
登录后参与讨论